Nama zeolit berasal dari kata “zein” yang berarti mendidih dan “lithos” yang artinya batuan, disebut demikian karena mineral ini mempunyai sifat mendidih atau mengembang apabila dipanaskan.Hal ini menggambarkan perilaku mineral ini yang dengan cepat melepaskan air bila dipanaskan sehingga kelihatan seolah-olah mendidih Zeolit merupakan kristal berongga yang terbentuk oleh jaringan silika alumina tetrahedral tiga dimensi dan mempunyai struktur yang relatif teratur dengan rongga yang di dalamnya terisi oleh logam alkali atau alkali tanah sebagai penyeimbang muatannya. Rongga-rongga tersebut merupakan suatu sistem saluran yang didalamnya terisi oleh molekul air (Ismaryata, 1999). Zeolit alam mempunyai beberapa sifat di antaranya dehidrasi, adsorbsi, penukar ion, katalisator dan separator (Amelia, 2003). Proses dehidrasi mempunyai fungsi utama melepas molekul air dari kerangka zeolit sehingga mempertinggi keaktifan zeolit dengan proses pemanasan. Dehidrasi menyebabkan zeolit mempunyai struktur pori yang sangat terbuka, dan mempunyai luas permukaan internal yang luas sehingga mampu mengadsorpsi sejumlah besar substansi selain air dan mampu memisahkan molekul zat berdasarkan ukuran molekul dan kepolarannya. Zeolit alam mempunyai struktur rangka, mengandung ruang kosong yang ditempati oleh kation dan molekul air yang bebas sehingga memungkinkan pertukaran ion atau chemisorptions (Adamson, 1990). Dengan adanya rongga intrakristalin, zeolit dapat digunakan sebagai katalis. Reaksi katalitik dipengaruhi oleh ukuran mulut rongga dan sistem alur, karena reaksi ini tergantung pada difusi pereaksi dan hasil reaksi.
Kemampuan katalitik maupun adsorpsi dari zeolit alam masih rendah, hal ini disebabkan adanya pengotor seperti logam – logam maupun material organik yang terdapat dalam kerangka maupun diluar kerangka zeolit. Oleh karena itu, perlakuan pendahuluan diperlukan untuk meningkatkan kemampuan bahan tersebut dalam pemanfaatannya. Aktivasi dapat meningkatkan kapasitas jerapan dan sifat yang diinginkan sesuai dengan penggunaannya. Aktivasi zeolit dapat dibagi menjadi dua cara yaitu aktivasi secara kimia dan aktivasi fisika.
Aktivasi kimia dilakukan melalui proses dealuminasi. Dealuminasi merupakan proses pelepasan atom Al dari zeolit. Dealuminasi ini dilakukan untuk meningkatkan rasio Si/Al. meningkatnya rasio Si/Al berarti juga akan meningkatkan situs asam dari zeolit itu sendiri. Situs asam ini merupakan situs yang berfungsi sebagai sisi aktif pada zeolit. Dengan meningkatnya situs asam berarti juga meningkatkan keaktivan zeolit. Pada percobaan ini deluminasi dilakukan dengan penambahan HCl. Selain menyebabkan terjadinya dealuminasi, penambahan asam ini dapat membersihkan permukaan pori, membuang senyawa pengotor dan mengatur kembali letak atom yang dipertukarkan.
Proses aktivasi fisika dilakukan dengan pemanasan (kalsinasi). Kalsinasi zeolit dimaksudkan untuk meningkatkan sifat-sifat khusus zeolit dengan cara menghilangkan unsur-unsur pengotor dan menguapkan air yang terperangkap dalam pori kristal zeolit.
Pengaruh proses dealuminasi terhadap keasaman zeolit dapat diketahui dengan membandingkan nilai keasaman zeolit yang mengalami dealuminasi (Zeolit Alam /ZA) dengan Zeolit Alam yang mengalami dealuminasi (Zeolit Alam Aktif /ZAA). Zeolit alam yang digunakan dalam percobaan ini adalah mordenit.
Tujuan Percobaan
Kompetisi yang diharapkan:
1. Memahami prinsip dealuminasi zeolit
2. Memahami fungsi situs asam zeolit
Keterampilan yang diharapkan:
1. Menguasai teknik refluks zeolit
2. Meguasai teknik kalsinasi zeolit
3. Menguasai teknik pengasaman zeolit
Manfaat Percobaan
Adapun manfaat yang diharapkan dari percobaan ini adalah:
1. Dapat memahami pengaruh dealuminasi terhadap keasaman zeolit
TINJAUAN PUSTAKA
Zeolit
Zeolit merupakan mineral hasil tambang yang bersifat lunak dan mudah kering. Warna dari zeolit adalah putih keabu-abuan, putih kehijau-hijauan, atau putih kekuning-kuningan. Ukuran kristal zeolit kebanyakan tidak lebih dari 10–15 mikron (Mursi Sutarti, 1994)
Zeolit terbentuk dari abu vulkanik yang telah mengendap jutaan tahun silam. Sifat-sifat mineral zeolit sangat bervariasi tergantung dari jenis dan kadar mineral zeolit. Zeolit mempunyai struktur berongga biasanya rongga ini diisi oleh air serta kation yang bisa dipertukarkan dan memiliki ukuran pori tertentu. Oleh karena itu zeolit dapat dimanfaatkan sebagai penyaring molekuler, senyawa penukar ion, sebagai filter dan katalis.
Kerangka dasar struktur zeolit terdiri dari unit-unit tetrahedral [AlO4] dan [SiO4] yang saling berhubungan melalui atom O (Barrer, 1987).
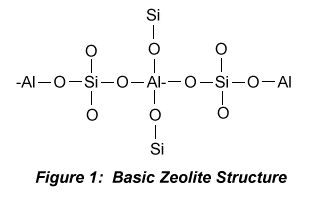
Dalam struktur tersebut Si4+ dapat diganti Al3+ (gambar 2), sehingga rumus umum komposisi zeolit dapat dinyatakan sebagai berikut :
Mx/n [(AlO2)x(SiO2)y] m H2O (Lesley dkk, 2001 : 238)
Dimana :
n = Valensi kation M (alkali / alkali tanah)
x, y = Jumlah tetrahedron per unit sel
m = Jumlah molekul air per unit sel
M = Kation alkali / alkali tanah
Zeolit dibedakan menjadi 2 jenis yaitu zeolit alam dan zeolit buatan. Zeolit alam terbentuk karena adanya perubahan alam (zeolitisasi) dari bahan vulkanik dan dapat digunakan secara langsung untuk berbagai keperluan, namun daya jerap maupun daya tukar ion zeolit ini belum maksimal. Untuk memperoleh zeolit dengan daya guna tinggi diperlukan suatu perlakuan yaitu dengan aktivasi. Sedangkan zeolit buatan merupakan hasil rekayasa manusia secara proses kimia yang bisa dimodifikasi sesuai kebutuhan.
Proses aktivasi zeolit alam dapat dilakukan dengan 2 cara, yang pertama yaitu secara fisika melalui pemanasan dengan tujuan untuk menguapkan air yang terperangkap di dalam pori-pori kristal zeolit, sehingga luas permukaannya bertambah (Khairinal, 2000). Proses pemanasan zeolit dikontrol, karena pemanasan yang berlebihan kemungkinan akan menyebabkan zeolit tersebut rusak.
Yang kedua aktivasi zeolit secara kimia dengan tujuan untuk membersihkan permukaan pori, membuang senyawa pengotor dan mengatur kembali letak atom yang dapat dipertukarkan. Proses aktivasi zeolit dengan perlakuan asam HCl pada konsentrasi 0,1N hingga 11N menyebabkan zeolit mengalami dealuminasi dan dekationisasi yaitu keluarnya Al dan kation-kation dalam kerangka zeolit. Aktivasi asam menyebabkan terjadinya dekationisasi yang menyebabkan bertambahnya luas permukaan zeolit karena berkurangnya pengotor yang menutupi pori-pori zeolit. Luas permukaan yang bertambah diharapkan meningkatkan kemampuan zeolit dalam proses penjerapan (Weitkamp, 1999). Menurut Hamdan yang dikutip oleh Dina tingginya kandungan Al dalam kerangka zeolit menyebabkan kerangka zeolit sangat hidrofilik. Sifat hidrofilik dan polar dari zeolit ini merupakan hambatan dalam kemampuan penjerapannya. Proses aktivasi dengan asam dapat meningkatkan kristalinitas, keasaman dan luas permukaan (Hari, 2001 yang dikutip oleh Dina).
Mordenit
Mordenit merupakan mineral zeolit yang langka, dengan rumus empiris (Ca,Na2,K2)Al2Si10O24•7(H2O).Sistem Kristal Mordenit adalah ortorombik. Mineral ini biasanya ditemukan di dalam batuan volcanik bersamasamadengan Stilbit dan Heulandit. Ditemukan pertamakali oleh Henry How, dan nama Heulandit diberikan berdasarkan nama suatu komunitas “Morden”. Mordenit merupakan salah satu jenis zeolit alam dengan rasio Si/Al yang tinggi. Hal ini menyebabkan mordenit memiliki stabilitas termal yang tinggi. Dehidrasi terjadi pada range 80 – 4000C.
Dealuminasi
Dealuminasi merupakan proses pelepasan atom Al dari zeolit. Dealuminasi dilakukan untuk megoptimumkan kandungan Alumunium dalam zeolit sehingga lebih stabil pada suhu tinggi. Dealuminasi juga dimaksudkan untuk mengontrol aktivitas keasaman maupun selektivitas zeolit. Perbandingan antara silika dan alumina yang tinggi menyebabkan aktivitas adsorpsi meningkat (Trisunaryanti, 1991). Jumlah situs asam Bronsted dari zeolit akan bertambah dengan bertambahnya kandungan alumunium didalamnya. Katalis zeolit dengan kandungan Al yang tinggi mempunyai kestabilan yang rendah pada suhu tinggi. Maka untuk mengoptimumkan kandungan Al dalam zeolit dilakukan dengan cara dealuminasi. Dealuminasi pada zeolit dapat dilakukan salah satunya dengan cara mereaksikannya dengan larutan asam, misalnya HNO3, HCl, atau H2SO4. Alumunium dalam zeolit dapat terekstrak dengan penambahan asam. Perlakuan asam pada dasarnya untuk meningkatkan rasio Si/Al. larutan HCl dapat mengekstrak alumunium dalam zeolit karena HCl dapat bereaksi dengan alumina.
Kalsinasi
Kalsinasi merupakan proses pemanasan suatu benda hingga temperaturnya tinggi, tetapi masih di bawah titik lebur untuk menghilangkan kandungan yang dapat menguap. Proses aktivasi zeolit melalui kalsinasi menyebabkan pelepasan air sehingga luas permukaan pori – pori zeolit bertambah yang meningkatkan kemampuan untuk adsrpsi. Kalsinasi zeolit dimaksudkan untuk meningkatkan sifat-sifat khusus zeolit dengan cara menghilangkan unsur-unsur pengotor dan menguapkan air yang terperangkap dalam pori kristal zeolit. Adapun reaksi yang terjadi selama kalsinasi adalah sebagai berikut:
Kalsinasi membakar aditif organic pada suhu tinggi
Reaksi:
Organik + O2 + suhu tinggi CO2 + H2O
Pengeringan zeolit biasanya dilakukan dalam ruang hampa dengan menggunakan gas atau udara kering nitrogen atau methana dengan maksud mengurangi tekanan uap airterhadap zeolit itu sendiri.
Zeolit dipanaskan untuk menghilangkan kandungan air dan bahan pengotor lainnya, sehingga menghasilka pori – pori yang bersih dan luas permukaan pori yang lebih besar. Kalsinasi dilakukan dengan meletakkan zeolit di dalam pipa nuccel dan dipanaskan dengan furnace. Dalam proses ini dialirkan pula gas N2 untuk mendorong impuritas keluar dari pori - pori zeolit.
Proses kalsinasi dilakukan dengan memasukkan zeolit hasil dealuminasi ke dalam pipa nuccel. Zeolit ini kemudian dipanaskan di dalam furnace bersuhu 600oC selama 5 jam. Waktu kalsinasi dihitung setelah tercapai suhu 600oC. Selama proses kalsinasi dialirkan pula gas N2 dengan laju alir 1L/menit.
Spektroskopi Infra Merah
Hampir semua senyawa yang memiliki ikatan kovalen baik organik maupun anorganik akan menyerap radiasi elektromagnetik dalam spektrum infra merah (Sastrohamidjojo, 1992). FT-IR merupaka alat yang dapat digunakan untuk karakterisasi zeolit, karena dapat memberikan informasi tentang keberadaan unit bangun tetrahedral pada zeolit. Spektra IR yang biasa digunakan untuk keperluan ini adalah daerah pada frekuensi 200 – 3400 cm-1. Daerah ini dapat dibagi menjadi daerah utama yaitu:
Jenis Vibrasi Vibrasi Internal (cm-1) Vibrasi Eksternal (cm-1)
Rentang asimetrik 1250-950 1150-1050
Rentang simetrik 720-650 820-750
Vibrasi cincin ganda - 650-500
Vibrasi tekuk TO4 500-420 -
Vibrasi pori terbuka - 420-300
Semua vibrasi rentangan diatas sangat sensitive untuk analisis struktur dan komposisi senyawa zeolit. Pergeseran frekuensi rentangan asimetri (1000-1100 cm-1) berhubungan dengan fraksi Al kerangka. Penurunan frekuensi terjadi apabila terjadi substitusi Si oleh Al.
METODE PERCOBAAN
Alat Percobaan
Adapun alat – alat yang digunakan selama percobaan ini adalah: peralatan gelas seperti gelas beaker, labu ukur 50 mL, 3 buah Erlenmeyer 100 mL, pipet ukur 10 mL, corong gelas, spatula, gelas arloji, peralatan refluks seperti: labu alas bulat, pendingin bola, statif, magnetic stirrer, hot plate, termometer, seperangkat alat titrasi, oven, alat kalsinasi, alat analisis instrumen spektrofotometer infra merah (FTIR-8201 PC Shimadzu), krus porselin, serta desikator.
Bahan Percobaan
Bahan – bahan yang digunakan dalam percobaan ini adalah: 10 gram zeolit alam jenis mordenit (5 gram untuk ZAA dan 5 gram untuk ZA), 15 mL HCl, larutan piridin, larutan NaOH 0,1 M, larutan HCl 0,1 M, indikator fenolftalein (pp), 0,2 gram kristal asam oksalat (CH2O4.2H2O)serta Akuades (Laboratorium Kimia Fisika FMIPA UGM).
Prosedur Percobaan
Karakterisasi Zeolit Alam
a. Zeolit alam (ZA)
Sebanyak 5 gram zeolit dicuci dengan akuades kemudian dikeringkan dalam oven pada suhu 1200C selama 3 jam. Setelah itu dikalsinasi selama 2 jam. Hasilnya dianalisis dengan spektroskopi IR.
b. Zeolit alam teraktivasi (ZAA)
Sebanyak 5 gram zeolit direfluks dalam 15 mL HCl 1 M dan diaduk dengan magnetic stirrer pada suhu 900C selama 30 menit. Setelah itu zeolit dicuci dengan akuades sebanyak 10 kali atau sampai pH nya netral (dengan penambahan larutan AgNO3 sampai tidak terbentuk endapan putih). Kemudian zeolit dikeringkan dalan oven pada suhu 1200C selama 2 jam. Zeolit dikalsinasi pada suhu 5500C selama 2 jam. Hasilnya dianalisis dengan spektroskopi IR.
Penentuan keasaman
a. Metode gravimetri
Krus porselin ditimbang dengan neraca analitik (W1) kemudian diisi dengan 1 gram ZA atau ZAA. Krus porselin dan sampel tersebut dipanaskan dengan oven pada temperatur 1200C selama 1 jam. Setelah itu didinginkan dan ditimbang (W2). Langkah berikutnya, krus porselin dan sampel dimasukkan kedalam desikator dan divakumkan sambil dialiri gas piridin selama 24 jam.
Pengaliran gas piridin dilakukan dengan menuangkan 2 mL piridin kedalam sebuah cawan dan diletakkan dalam desikator yang sama dengan ZA dan ZAA.
b. Metode titrasi
Diambil 1 gram ZA atau ZAA dan direndam dalam 50 mL NaOH 0,1 Msambil diaduk dengan magnetik stirrer selama 2 jam. Setelah itu didiamkan selama 24 jam. Larutan kemudian dipisahkan dari ZAA dan diambil 10 mL serta ditambahkan indicator pp untuk titrasi dengan HCl 0,1 M. Titrasi dilakukan sebanak 3 kali.
Standarisasi larutan NaOH dan HCl
a. Standarisasi larutan NaOH
Dilarutkan 0,2 gram kristal asam oksalat (C2H2O4.2H2O) dalam 50 mL akuades. Selanjutnya diambil 10 mL larutan asam oksalat yang telah dibuat dan ditambahkan 2 tetes indikator pp, kemudian dititrasi dengan NaOH 0,1 M sebanyak 3 kali.
b. Standarisasi larutan HCl
Sebanyak 5 mL larutan HCl 0,1 M ditambah dengan 2 tetes indikator pp kemudian dititrasi dengan NaOH yang telah distandarisasi sebanyak 3 kali.
HASIL DAN PEMBAHASAN
Pada percobaan akan dilihat pengaruh dealuminasi terhadap keasaman zeolit. Untuk membandingkannya maka percobaan ini dibagi menjadi dua kelompok, kelompok pertama menentukan keasaman zeolit alam yang tidak didealuminasi (kelompok ini kemudian disebut sebagai kelompok ZA), sedangkan kelompok kedua menentukan keasaman zeolit setelah dealuminasi (yang kemudian dikenal sebagai zeolit alam teraktivasi (ZAA)).
Aktivasi Zeolit
a. Zeolit alam (ZA)
Dalam percobaan ini sampel ZA digunakan sebagai pembanding terhadap ZAA. Zeolit ini dicuci dengan akuades sebanyak 10 kali kemudian dikeringkan dalam oven pada suhu 120oC selama 2 jam. Proses pencucian ini dilakukan untuk melarutkan pengotor - pengotor pada zeolit. Adanya pengotor – pengotor ini akan mengganggu proses adsorpsi oleh zeolit. Pengotor – pengotor pada zeolit dapat larut dalam akuades karena mempunyai kepolaran yang sama atau mirip dengan H2O. Pengotor – pengotor yang terdapat pada zeolit umumnya berupa ion logam – logam yang bersifat polar. Sedangkan zeolit sendiri tidak larut dalam air karena ia bersifat polar. Hal ini sesuai dengan kaidah like dissolve like dimana senyawa yang mempunyai kepolaran yang sama akan saling melarutkan.
Proses pemanasan menggunakan oven ini bertujuan untuk menguapkan air yang terperangkap di dalam pori-pori kristal zeolit sehingga luas permukaannya bertambah. Proses pemanasan dikontrol karena pemanasan yang berlebihan kemungkinan akan menyebabkan zeolit tersebut rusak rusak. Zeolit alam yang telah dikeringkan ini kemudian didinginkan dan dikarakterisasi menggunakan IR.
b. Zeolit alam teraktivasi (ZAA)
Proses aktivasi yang dilakukan terhadap zeolit alam ini terdiri dari dua bagian yaitu aktivasi secara kimia dan aktivasi secara fisika. Aktivasi secara kimia dikenal dengan proses dealuminasi. Pada proses dealuminasi ini zeolit direfluks dalam 15 mL HCl 1 M dan diaduk dengan magnetic stirrer pada suhu 900C selama 30 menit. Skema roses dealuminasi ditunjukkan dalam gambar IV.1
Gambar IV.1 Skema proses dealuminasi
Pada proses dealuminasi digunakan peralatan-peralatan yang sederhana, berupa labu leher 3 dengan magnetik stirer sebagai pengaduk. Rangkaian alat ini merupakan model reaktor berpengaduk dalam skala laboratorium. Digunakan pendingin balik untuk mengkondensasikan kembali uap yang terbentuk sehingga tidak ada massa yang hilang.
Proses dealuminasi oleh HCl akan menyebabkan lepasnya atom-atom Al dalam kerangka zeolit sehingga rasio Si/Al akan meningkat. Reaksinya adalah sebagai berikut:
Setelah direfluks dengan HCl, zeolit dicuci dengan aquades hingga seluruh ion Cl- hilang. Tes dengan larutan AgNO3 dilakukan sebagai parameter bahwa zeolit telah bersih. Prinsip dari tes dengan AgNO3 didasarkan pada prinsip titrasi argentometri. Adapun reaksi yang terjadi ketika penambahan AgNO3 adalah sebagai berikut:
Ag+ + Cl- AgCl (endapan putih)
Jika ketika ditambahkan AgNO3 masih terbentuk endapan putih maka dapat dikatakan bahwa didalam larutan masih terdapat Cl- Maka proses pencucian dilanjutkan sampai semua Cl- hilang, hal ini ditandai dengan tidak terbentuknya endapan putih ketika ditambahkan larutan AgNO3. Zeolit yang telah bersih dikeringkan dalam oven. Kemudian dilakukan proses kalsinasi. Kalsinasi zeolit dimaksudkan untuk meningkatkan sifat-sifat khusus zeolit dengan cara menghilangkan unsur-unsur pengotor dan menguapkan air yang terperangkap dalam pori kristal zeolit. Adapun reaksi yang terjadi selama kalsinasi adalah sebagai berikut:
Kalsinasi membakar aditif organic pada suhu tinggi
Reaksi:
Organik + O2 + suhu tinggi CO2 + H2O
Dalam proses ini dialirkan pula gas N2 untuk mendorong impuritas keluar dari pori - pori zeolit.
Setelah proses kalsinasi ini, selanjutnya zeolit dikarakterisasi menggunakan IR.
Analisis Spektroskopi Inframerah terhadap Mordenit
a. Analisis Spektra Infra Merah Zeolit Alam (ZA)
Analisis Inframerah dilakukan untuk penentuan gugus aktif di padatan zeolit. Analisis spektra inframerah dikelompokkan menjadi 2 bagian, yaitu pada bilangan gelombang 4000-1250 cm-1 dan 1250-350 cm-1. Kelompok pertama mengamati gugus yang bukan merupakan identitas spesifik dari struktur zeolit sedangkan kelompok kedua merupakan identitas spesifik dari struktur zeolit. Hasil pengamatan dengan spektrofotometer inframerah menunjukkan puncak-puncak yang spesifik. Spektra inframerah zeolit alam tersaji pada gambar IV.2.
Gambar IV.2 Spektra IR ZA
Gambar IV.2 menunjukkan bahwa zeolit alam mempunyai puncak serapan pada daerah bilangan gelombang 3433,29 ; 1635,64 ; 1010,70 ; 794,67 ; 478,35 ; 432,05 cm-1. Pada gambar IV.2 puncak 3433,29 cm-1 menunjukkan serapan dari gugus O-H pada zeolit terhidrasi. Pita serapan pada daerah 3433,29 cm-1 merupakan vibrasi ulur O-H dari molekul air yang teradsorb. Dan serapan pada 1635,64 cm-1 merupakan vibrasi tekuk gugus O-H dari molekul H2O yang teradsorb. Puncak 1010,70 cm-1adalah serapan yang menunjukkan adanya vibrasi regangan asimetris Si-O atau Al-O pada TO4 pada jalinan internal. Puncak 794,67cm-1merupakan interpretasi dari serapan ikatan pada unit struktur utama zeolit yang berbentuk asimetris, vibrasi tekuk Si-O pada jalinan eksternal (kerangka zeolit). Serapan vibrasi bending T-O berada pada kisaran 420-500 cm-1. Puncak 478,35 cm-1 pada gambar IV.2 menunjukkan adanya vibrasi tekuk dari ikatan T-O. Puncak ini merupakan interpretasi dari jalinan internal pada kerangka zeolit.
Perbandingan spektra inframerah zeolit alam dengan reherensi yang ada disajikan dalam tabel IV.1. Berdasarkan hasil analisis spektroskopi inframerah tersebut dapat disimpulkan bahwa zeolit alam menunjukkan karakter kerangka struktur zeolit.
Tabel IV.1 Spektra Inframerah dari Jenis Vibrasi Zeolit Alam
Vibrasi Bilangan Gelombang (cm-1)
Zeolit Alam Referensi
Vibrasi ulur O-H 3433,29 3435 (Carrado dkk, 2001)
Vibrasi ulur TO4 1010,70 1043,3 dan 1052,3 (Heraldy, 2003)
Vibrasi bending T-O pada jalinan internal (kerangka zeolit) 478,35 ; 432,05 420 - 500
Regangan asimetri pada jalinan internal 1010,70 950 – 1250
Pori terbuka (jalinan eksternal) 478,35 ; 432,05 ; 794,67 420 – 800
Regangan asimetri pada jalinan eksternal 794,67 750 - 820
b. Analisis Spektra Infra Merah Zeolit Alam Teraktivasi (ZAA)
Spektra inframerah zeolit alam dan zeolit hasil perlakuan akan disajikan dalam gambar IV.3
Dari hasil analisis IR terhadap ZA dan ZAA tampak terjadi pergeseran frekuensi dari 1010,70 menjadi 1035,85 dan 1095,57 cm-1. Pergeseran frekuensi rentangan asimetri ini berhubungan dengan fraksi Al yang beraada pada struktur tetrahedral zeolit. Jika jumlah Al didalam struktur tetrahedral zeolit berkurang , maka akan terjadi pergesaeran kearah frekuensi yang lebih tinggi. Karena berkurangnya kandungan atom Al dalam kerangka maka jarak antar Al akan semakin jauh sehingga interaksi antar atom Al akan berkurang dan kebebasan gerak Al akan bertambah. Hal tersebut mengakibatkan vibrasi yang timbul dari Al saat dikenai radiasi IR akan semakin besar. Karena vibrasi yang ditimbulkan besar maka energy vibrasinya (energy yang dibutuhkan untuk membuat atom melakukan gerak vibrasi) akan semakin besar. Sehingga bedrdasarkan persamaan E = hc/ maka energi akan berbanding lurus dengan 1/ (bilangan grlombang). Dengan demikian proses dealuminasi dapat diamati dengan IR, walaupun hasil yang didapatkan bersifat kualitatif.
Pada serapan 650 – 750 cm-1 juga terjadi perubahan intensitas yang jelas. Terlihat bahwa pada ZAA muncul serapan pada bilangan gelombang 694,37 cm-1 (vibrasi ulur simetri T-O jalinan internal), frekuensi ini tidak didapatkan pada ZA.
Pada kisaran bilangan gelombang 2900 – 3000 cm-1 (C-H regang dari bahan anorganik) teramati adanya perbedaan antara ZA dan ZAA. Dimana pada ZA serapan muncul serapan pada bilangan gelombang 2931,90 cm-1, sedangkan pada ZAA tidak ditemui adanya serapan pada rentang bilangan gelombang tersebut. Ini berarti bahwa ZAA telah kehilangan gugus C-H organik yang disebabkan karena proses kalsinasi.
Untuk serapan pada daerah bilangan gelombang dibawah 500 cm-1 menunjukkan adanya pori terbuka. Pada kisaran bilangan gelombang ini terjadi penurunan frekuensi yaitu dari 432,05 cm-1 menjadi 408,91cm-1. Semakin banyak jumlah pori yang terbuka maka serapan energi yang dibutuhkan untuk bervibrasi akan semakin kecil, energy ini benrbanding lurus dengan bilangan gelombang.
Hasil interpretasi terhadap spectra IR membuktikan bahwa perlakuan asam mampu menyebabkan dealuminasi pada padatan zeolit. Serapan vibrasi pori terbuka mengalami peningkatan intensitas. Perlakuan HCl menghilangkan pengotor yang berada pada pori zeolit sehingga pori zeolit semakin bersih.
Penentuan Derajat Keasaman
Keasaman adalah jumlah milimol asam persatuan berat atau luas permukaan sampel padatan. Besaran ini diperoleh melalui pengukuran jumlah basa yang berinteraksi dengan gugus asam padatan, dimana jumlah basa yang teradsorp adalah ekivalen dengan jumlah asam pada permukaan padatan yang menyerang basa tersebut. Keasaman pada zolit berasal dari situs asam Brostead dan Lewis. Dalam percobaan ini digunakan dua metode untuk menentukan derajad keasaman, metode yang pertama yaitu metode titrasi menggunakan basa NaOH, dan metode yang kedua adalah metode gravimetri menggunakan basa piridin.
a. Metode Titrasi
Metode titrasi ini dilakukan dengan merendam ZA dan ZAA dengan basa NaOH. Selama proses perendaman ini basa NaOH akan teradsorp oleh situs asam pada zeolit. Setelah itu larutan kemudian dipisahkan dari ZA dan ZAA. Konsentrasi NaOH awal didapatkan dari hasil standarisasi larutan NaOH oleh suatu asam lemah, dalam hal ini adalah asam oksalat (H2C2O4). Proses standarisasi ini perlu dilakukan karena NaOH merupakan suatu larutan standar sekunder yang konsentrasinya tidak bisa langsung ditentukan dengan dengan melarutkannya dalam labu ukur sehingga perlu distandarisasi oleh suatu larutan standar primer. Indikator yang digunakan dalam percobaan ini adalah indikator fenophtalein. Indikator fenophtalein digunakan dalam percobaan ini karena fenophtalein tak berwarna dengan pH antara 8,3-10,0 akan mempermudah praktikan dalam mengetahui bahwa dalam proses sudah mencapai titik ekivalen. Perubahan yang terjadi pada proses penitrasian ini adalah berubah menjadi warna merah yang konstan dari warna asal mula bening. Perubahan warna ini menendai telah tercapainya titik ekivalen. Volume NaOH yang diperlukan standarisasi adalah5 mL yang dihitung dari rata-rata tiga kali percobaan. Dan pada penentuan konsentrasi NaOH didapat konsentrasi NaOH sebesar 0,126984 M.
Setelah proses perendaman ZA dalam NaOH didapatkan konsentrasi NaOH sisa sebesar 0,10252 M. Dari hasil ini terlihat bahwa konsentrasi NaOH berkurang karena sebagian NaOH teradsorp oleh situs asam yang terdapat pada zeolit. Dari hasil perhitungan didapatkan derajat keasaman untuk ZA adalah 1,2232 mmol/gram. Sedangkan konsentrasi NaOH setelah proses perendaman NaOH dalam ZAA adalah 0,0994 M. Dan dari hasil perhitungan didapatkan derajat keasaman untuk ZAA adalah 1,3792 mmol/gram. Derajat keasaman ZAA lebih tnggi dari pada ZA. Ini membuktikan bahwa proses dealuminasi dapat meningkatkan derajat keasaman pada zeolit.
b. Metode Gravimetri
Penentuan keasaman secara gravimetri dalam percobaan ini menyatakan jumlah total situs asam Bronsted dan Lewis yang terdapat dalam permukaan dan pori dari zeolit. Basa yang digunakan dalam metode gravimetri ini adalah piridin. Piridin merupakan suatu basa lemah dengan berat molekul 79,1. Senyawa ini tidak bewarna dan berbau menyengat. Keasaman ditentukan sebagai banyaknya piridin yang dapat teradsorb pada permukaan dan pori zeolit.
Pada percobaan ini gas piridin dialirkan dalam desikator yang berisi ZA dan ZAA. Pengaliran gas piridin dilakukan dengan menuangkan 2 mL piridin kedalam sebuah cawan dan diletakkan dalam desikator yang sama dengan ZA dan ZAA.
Dari hasil percobaan didapatkan massa zeolit sesudah dialiri gas piridin bertambah, baik untuk ZA maupun ZAA. Hal ini mengindikasikan bahwa piridin telah teradsorp pada permukaan zeolit. Dari hasil perhitungan didapatkan nilai derajat keasaman untuk ZA dan ZAA dengan metode gravimetri ini adalah sama yaitu 1,345 mmol/gram.
Situs asam dimungkinkan tidak dapat berinteraksi semuanya dengan basa karena terdapatnya hambatan yang menghalangi molekul basa menuju situs asam tersebut. Hambatan tersebut dapat berupa terlalu besarnya ukuran basa yang digunakan sehingga tidak dapat masuk kedalam pori yang lebih kecil dari ukurannya sehingga tidak dapat berinteraksi dengan asam yang ada didalam pori, padahal zeolit tersusun atas saluran – saluran yang panjang dan banyak. Fenomena ini mungkin terjadi pada piridin, sedangkan NaOH karena ukurannya yang kecil dapat leluasa masuk pada hampir semua situs oksida mikropori, sehingga keasaman dengan NaOH lebih bagus daripada piridin.
BAB V
PENUTUP
Kesimpulan
1. Dealuminasi dapat meningkatkan rasio Si/Al
2. Derajat keasaman ZA dan ZAA dengan metode titrasi berturut – turut adalah 1,2232 mmol/gram
3. Derajat keasaman ZA dengan metode gravimetri adalah 1,345 mmol/gram
4. NaOH lebih baik dalam menentukan derajat keasaman mordenit dari pada piridin karena ukurannya yang lebih kecil, sehingga bisa teradsorp pada permukaan pori – pori zeolit.
salam,
BalasHapusboleh saya minta paper atau tulisan lengkapnya, untuk tugas kuliah.
ke shantymerissa@gmail.com
terimakasih
Disebutkan ada 2 cara aktivasi 1. Fisika; kalsinasi atau pemanasan suhu tinggi 2. kimia dengan asam. Tapi kemudian anda mengatakan di proses Kalsinasi anda menyebutkan "Proses kalsinasi dilakukan dengan memasukkan zeolit hasil dealuminasi....dst" ...kalo membaca kalimat tsbt cara aktivasi itu cuma satu dong yaitu gabungan cara kimia n fisika, krn zeolitnya di asamkan/dialuminasi dulu (cara kimia) dilanjutkan dengan kalsinasi....tul gak?...heheh
BalasHapusboleh saya minta paper atau tulisan lengkapnya, untuk membantu saya dalam penulisan skripsi.
BalasHapusminta tolong kirim ke fitria0064a@gmail.com
terima kasih
maaf emailnya ada kesalahan,, fitria0064@gmail.com
HapusKalau boleh tau asam mana yang paling bagus untuk proses dealuminasi antara H2SO4 dengan HNO3
BalasHapus